どうしてなのかな
上の写真は身近にある金属を使った電池です。なんと、2種類の金属を食塩水にひたすだけ。このとき、アルミがマイナス(-)極、銅がプラス(+)極。回路計につなぐと、わずかに電気が流れていることがわかります。アルミ、銅、鉄で試した場合、アルミと銅を組み合わせた場合の電圧が最も高く、鉄は銅と組み合わせると-極、アルミと組み合わせると+極になりました。金属の組み合わせによって、電気の強さと流れる向きがちがうみたい?!
そうかなるほど
金属には陽イオン※1になりやすい性質があります。つまり、金属原子から電子がはなれてプラスの電気をおびやすいという性質です。この陽イオンへのなりやすさを金属のイオン化傾向といいます。金属によってイオン化傾向には差があり、イオン化傾向の大きい順にならべたものをイオン化列といいます(図1)。このイオン化傾向が電気の強さ(電圧)と流れる向き(極性)に関係しています。電気を通す溶液(今回の実験では食塩水)にひたした金属は、わずかにとけだして陽イオンになります。陽イオンになるときにはなれた電子は、金属の表面に残されます。2種類の金属を食塩水にひたしてリード線でつなぐと、電子は数の多い方から少ない方へ移動し、電流になります。電子を出す方が-極、入る方が+極。アルミは、鉄や銅よりイオン化傾向が大きく陽イオンになりやすいため、その表面に残る電子の数が鉄や銅よりも多く、-極になります。逆に銅は、アルミや鉄にくらべてイオン化傾向が小さく、その表面に残る電子の数が少ないため、+極になります。鉄のイオン化傾向は、銅より大きくアルミより小さいため、銅と組み合わせると-極になり、アルミと組み合わせると+極になります。また、2種類の金属のイオン化傾向の差が大きいほど、移動する電子の数が多いため、より強い電気が取り出せます。アルミと銅を組み合わせた場合の電圧が一番高いのは、鉄との組み合わせにくらべて、イオン化傾向の差が大きいからなのです。
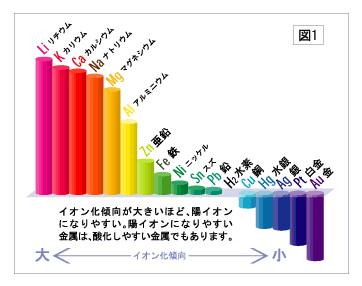
※1:イオン
あらゆる物質は原子が集まってできています。原子はプラスの電気をもつ原子核とマイナスの電気をもついくつかの電子でできていて、ふだんはプラスとマイナスが打ち消し合って電気をおびていない中性の状態になっています。この原子から電子がはなれると、マイナスの電気量が減ってプラスの電気をおびます。逆に電子が加わると、マイナスの電気量が増えてマイナスの電気をおびます。このように原子や分子がプラスやマイナスの電気をおびたものをイオンといい、前者を陽イオン、後者を陰イオンといいます。
材料
1. プラスチックトレー(食品用トレーなど) 1枚
※20cm×20cm×深さ3cmより大きいもの
2. 食塩 約100g
3. 回路計(テスター、マルチメーター)
※0.1~2Vの直流電圧が測定できるもの
4. クリップ付きリード線 2本
5. アルミ製品(例:アルミ皿) 1個
6. 銅製品(例:洗面排水口ごみ受け) 1個
7. 鉄製品(例:五寸くぎ) 1個


工作の完成品
![]()
[実験の注意]
・NGKサイエンスサイトで紹介する実験は、あくまでも家庭で手軽にできる科学実験を目的としたものであり、工作の完成品は市販品と同等、もしくは代用品となるものではないことを理解したうえで、個人の責任において実験を行ってください。
・回路計を使う際は、必ず取扱説明を確認し、正しく使いましょう。
・工作・実験を行う際は、必ず手順を読んでから行ってください。
・器具の取り扱いには十分注意し、けがをしないようにしましょう。
・小学生など低年齢の方が実験を行う場合は、必ず保護者と一緒に行ってください。
-
1

トレーに水をはって食塩を少しずつとかし、できるだけ濃い(飽和水溶液に近い)食塩水をつくります。
-
2

回路計のスイッチを直流電圧(DC-V)にあわせておきます。
※オートレンジ機能がない場合、測定範囲(レンジ) のダイヤルを1.5~3Vの位置にあわせます。
回路計の機種によって使用方法がことなる場合があります。使用する回路計の取扱説明を確認し、正しく使いましょう。 -
3
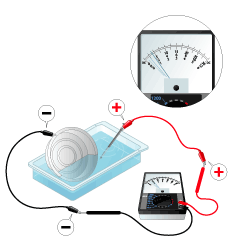
2種類の金属それぞれにリード線をつなぎ、金属どうしが接触しないように食塩水にひたします。回路計の赤(+側)のテスター棒にイオン化傾向の小さい金属を、黒(-側)のテスター棒にイオン化傾向の大きい金属を接続し、直流電圧を測定します。
※回路計に接続する極性を誤るとマイナスの値を 示しますが、機種によってはこわれる原因になり ますので注意してください。 -
4
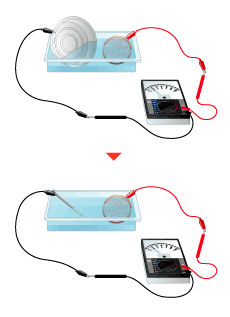
金属の組み合わせを変えて(3)の手順をくり返し、それぞれの測定値と極性を、イオン化列に照らし合わせて確認します。
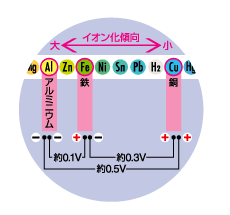
※数値は、記載の条件で 実験した結果です。数値は 実験条件によって異なります。
NGKサイエンスサイトで紹介する実験は、あくまでも家庭で手軽にできる科学実験を目的としたものです。工作の完成品は市販品と同等ではなく、代用品にもならないことを理解したうえで、個人の責任において実験を行ってください。
NGKサイエンスサイトは日本ガイシが運営しています。ご利用に当たっては、日本ガイシの「プライバシーポリシー」と「ご利用条件•ご注意」をご覧ください。
本サイトのコンテンツ利用に関しては、本サイトお問い合わせ先までご相談ください。





